Задание № 31957
В реактор постоянного объёма поместили N2H4 и водород. При этом исходная концентрация N2H4 составляла 0,55 моль/л. В результате протекания обратимой реакции N2H4 (г.) + H2 (г.) ⇋ 2NH3 (г.) В реакционной системе установилось химическое равновесие, при котором концентрации водорода и аммиака составили 0,32 моль/л и 0,18 моль/л соответственно. Определите исходную концентрацию водорода (X) и равновесную концентрацию N2H4 (Y).
Выберите из списка номера правильных ответов.
1) 0,09 моль/л
2) 0,37 моль/л
3) 0,41 моль/л
4) 0,46 моль/л
5) 0,50 моль/л
6) 0,55 моль/л
[topic]
Для решения задачи необходимо составить таблицу, перенести в неё данные из условия и заполнить пропуски, пользуясь следующими правилами:
1) исходные концентрации продуктов всегда равны 0.
2) ΔС (изменение концентрации) находится как разность между равновесной концентрацией Сравн и исходной концентрацией Сисх (ΔC = Cравн – Cисх).
3) изменение концентрации разных участников реакции пропорционально коэффициентам в реакции и имеет противоположный знак у продуктов и реагентов.
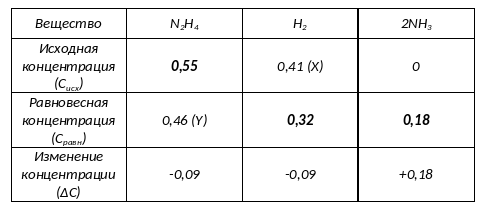
Жирным шрифтом выделены данные, известные из условия.
Ответ: 34Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.