Вариант 12
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
1) Na
2) Н
3) F
4) Li
5) С
Определите, атомам каких из указанных в ряду элементов до завершения слоя не хватает одного электрона. Запишите в поле ответа номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной подгруппе. Расположите выбранные элементы в порядке усиления кислотных свойств образуемых ими гидроксидов.
1) Be
2) Al
3) Sr
4) Zn
5) Mg
Из числа указанных элементов выберите два элемента, которые не проявляют валентности, равной номеру группы.
1) Be
2) O
3) Cl
4) Mn
5) N
Из предложенного перечня выберите два вещества ионного строения, которые содержат ковалентную полярную связь.
1) HBr
2) NH4H2PO4
3) Na2O
4) Сa(ClO3)2
5) CH3OH
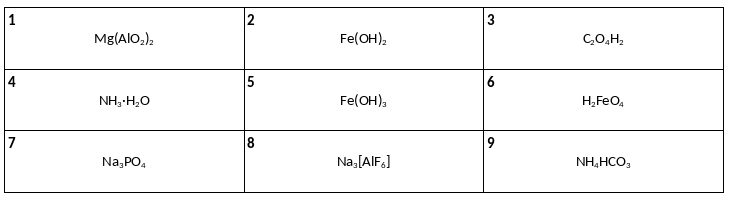
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) комплексной соли, Б) кислой соли, В) амфотерного гидроксида.
Даны две пробирки с раствором вещества Х. В одну из них добавили раствор нитрата железа(II), при этом наблюдали выпадение осадка. В другую пробирку добавили раствор сильного электролита Y. При этом прошла реакция, не сопровождающаяся выделением газа или выпадением осадка. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) HCl
2) NH3
3) Cu(OH)2
4) Na2S
5) K2CO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Li
Б) CO2
В) Ba(OH)2
Г) Ca(HCO3)2
РЕАГЕНТЫ
1) HCl, Ca(OH)2, Na2SiO3
2) H2, KOH, Na2SO4
3) CuCl2, NaНСO3, Li2SO4
4) C, Mg, NaOH
5) H2O, N2, Cl2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cl2
Б) SiO2
В) K2CO3
Г) Fe2(SO4)3
РЕАГЕНТЫ
1) HF, NaOH, СаO
2) НСl, Аl2O3, СаСl2
3) LiOH, KI, ВаСl2
4) H2SO4, O2, СO2
5) Mg, H2S, Н2
В заданной схеме превращений
Al2S3X→H2SY→SO2
веществами X и Y соответственно являются:
1. Ca
2. NaOH
3. H2O
4. NH3
5. O2
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилацетат
Б) метилэтиловый эфир
В) метиловый эфир муравьиной кислоты
КЛАСС/ГРУППА
1) простой эфир
2) сложный эфир
3) альдегид
4) углевод
Из предложенного перечня выберите два вещества, которые являются структурными изомерами метилциклопентана.
1. циклопентан
2. циклогексен
3. 2,3-диметилбутен-2
4. гексен-2
5. этилциклопентан
Из перечисленных веществ выберите все вещества, для которых возможна реакция гидрирования.
1) пропен
2) бензол
3) бутин-2
4) 2-метилпентан
5) 1,2-дихлорэтан
Из предложенного перечня выберите два вещества, с которыми реагирует аланин.
1. пропан
2. метилэтиловый эфир
3. сульфат натрия
4. гидрокарбонат натрия
5. соляная кислота
Установите соответствие между углеводородом и продуктом, который преимущественно образуется при его взаимодействии с хлороводородом в соотношении 1:1. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УГЛЕВОДОРОД
А) этилен
Б) пропин
В) циклобутан
Г) бутадиен-1,3
ПРОДУКТ РЕАКЦИИ
1) 2-хлорпропен
2) 1-хлорбутен-2
3) 1-хлорпропан
4) хлорэтан
5) 1-хлорбутан
6) 2-хлорбутен-1
Установите соответствие между веществом, которое вступает в реакцию с этанолом, и преимущественно образующимся углеродсодержащим продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) СuО
Б) KMnO4(H+)
В) Н2SO4 (конц. 180)
Г) K
ПРОДУКТ РЕАКЦИИ
1) ацетат калия
2) этилат калия
3) ацетальдегид
4) уксусная кислота
5) диметиловый эфир
6) этилен
Задана следующая схема превращений веществ:
C2H4X→C2H5OHY→C2H5ONa
Определите, какие из указанных веществ являются веществами X и Y.
1. Na
2. NaHCO3
3. Na2CO3
4. H2O
5. Cu(OH)2
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие растворов гидроксида калия и соляной кислоты.
1. обратимая
2. экзотермическая
3. каталитическая
4. реакция нейтрализации
5. гетерогенная
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции конверсии метана.
1. Повышение давления
2. Понижение концентрации метана
3. Увеличение температуры
4. Добавление ингибитора
5. Увеличение объема реакционного сосуда
Установите соответствие между схемой реакции и свойством элемента бром, которое он проявляет в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) C2H4 + Br2 → C2H4Br2
Б) KOH + Br2 → KBrO3 + KBr + H2O
В) NH4Br + AgNO3 → NH4NO3 + AgBr
СВОЙСТВО БРОМА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восстановитель
Установите соответствие между формулой соли и продуктами электролиза её водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Mg(NO3)2
Б) КВr
В) СаСl2
Г) Hg(NO3)2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) водород и галоген
4) металл и галоген
5) металл и водород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Хлорид железа (II)
2) Гипохлорит калия
3) Гидроксид стронция
4) Хлорид кальция
Для системы С4Н8(г) + Н2(г) ⇄ С4Н10(г) + Q установите соответствие между изменением внешних условий и состоянием химического равновесия в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ ВНЕШНИХ УСЛОВИЙ
А) увеличения концентрации водорода
Б) повышения температуры
В) повышения давления
Г) использования катализатора
СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной веществ
3) смещение равновесия не происходит
В реактор постоянного объёма поместили водород и углекислый газ. При этом исходная концентрация водорода составляла 0,9 моль/л. В результате протекания обратимой реакции H2 (г.) + CO2 (г.) ⇋ H2O (г.) + CO (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида углерода(IV) и оксида углерода(II) составили 0,1 моль/л и 0,6 моль/л соответственно. Определите равновесную концентрацию H2 (X) и исходную концентрацию CO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,3 моль/л
3) 0,5 моль/л
4) 0,7 моль/л
5) 0,9 моль/л
6) 1,1 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) Nal и NaF
Б) ZnBr2 и MgBr2
В) КСl и НСl
Г) KF и HNO3
РЕАКТИВ
1) NaOH (р-р)
2) AgNO3(p-p)
3) H2SO4(p-p)
4) KCl(p-p)
5) NaHCO3
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) ацетилен
Б) этиленгликоль
В) пропан
Г) тринитроглицерин
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в составе незамерзающих жидкостей
2) в качестве топлива
3) получение каучука
4) сварка и резка металлов
5) в качестве лекарственного средства
Смешали 250 г раствора с массовой долей соли 12% и 300 г раствора с массовой долей этой же соли 8%. Чему равна масса соли в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: ______________г
Определите объём (н.у.) водорода, который теоретически необходим для синтеза 200 л (н.у.) хлороводорода из простых веществ. (Запишите число с точностью до целых.)
Ответ: _____________ л
Определите объём (л) оксида серы(IV) (н.у.), который может быть теоретически получен из 1 кг пирита с содержанием основного вещества 93,6%. (Запишите число с точностью до сотых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Сульфат стронция, серная кислота, гидроксид меди(II), дихромат натрия, ацетат меди(II), сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется две соли и простое вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
3Na2S + Na2Cr2O7 + 7H2SO4 = 3S + Cr2(SO4)3 + 4Na2SO4 + 7H2O
2) Указан электронный баланс
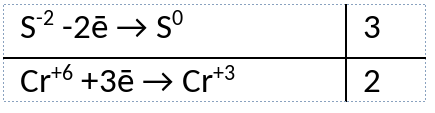
3) Указано, что хром в степени окисления +6 (дихромат натрия) является окислителем, а сера в степени окисления -2 (сульфид натрия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. Реакция идёт без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
(CH3COO)2Cu + H2SO4 = 2CH3COOH + CuSO4
2) Написано полное ионное уравнение:
2CH3COO- + Cu2+ + 2H+ + SO42- = 2CH3COOH + Cu2+ + SO42-
3) Написано сокращённое ионное уравнение:
CH3COO- + H+ = CH3COOH
Иодоводородную кислоту нейтрализовали гидрокарбонатом калия. Полученная соль прореагировала с раствором, содержащим дихромат калия и серную кислоту. При взаимодействии образовавшегося простого вещества с алюминием получили соль. Эту соль растворили в воде и смешали с раствором сульфида калия, в результате чего образовался осадок и выделился газ. Напишите уравнения четырёх описанных реакций.
1) КНСO3 + HI = KI + Н2O + CO2↑
2) К2Сr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 +
4K2SO4+ 7H2O
3) 2Al + 3I2 = 2AlI3
4) 2AlI3 + 3K2S + 6H2O = 2Аl(ОН)3| + 3H2S↑ + 6KI
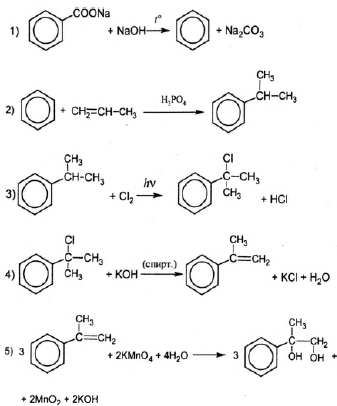
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
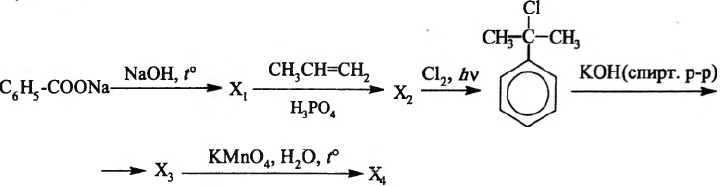
При написании уравнений реакций используйте структурные формулы органических веществ.
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
Общая формула вещества - СхНуOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
n(СO2) = 28 / 22,4 = 1,25 моль
n(Н2O) = 22,5 / 18 = 1,25 моль
M(СхНуОz) = 3,125 • 22,4 = 70 г/моль
n(CxHyOz) = 17,5 / 70 = 0,25 моль
2) Определена молекулярная формула вещества:
n(С) = n(СO2) = 1,25 моль
n(Н) = 2n(Н2O) = 2,5 моль
х = n(C) / n(CxHyOz) = 1 * 25 / 0,25 = 5
у = n(Н) / n(СхНуОz) = 2,5 / 0,25 = 10 5 • 12 + 10 + z • 16 = 70
z = 0
Молекулярная формула вещества - С5Н10
3) Составлена структурная формула вещества:
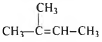
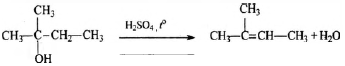
4) Составлено уравнение реакции получения вещества из третичного спирта:
Через 240 граммов 20 %-ного сульфата меди (II) пропустили сероводород. При этом массовая доля сульфата меди (II) в растворе уменьшилась до 2,15 %. К полученному раствору добавили 128 г 25 %-ого раствора гидроксида натрия. Определите массовую долю гидроксида натрия в конечном растворе после всех реакций. В ответе запишите уравнения реакций, которые указаны в условии задачи; и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
[1] CuSO4 + H2S ⟶ CuS + H2SO4
[2] CuSO4 + 2NaOH ⟶ Cu(OH)2 + Na2SO4
[3] H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
2. Найдем число моль сульфата меди(II) в исходном растворе:
m CuSO4 = mр-ра CuSO4 · ω CuSO4 = 240 · 0,2 = 48 г
n CuSO4 = m CuSO4 / M CuSO4 = 48 / 160 = 0,3 моль
3. Найдем число моль прореагировавшего сульфата меди(II):
Пусть nпрореаг. CuSO4 = x моль, тогда n CuS = n H2S = n H2SO4 = x моль
m CuS = n CuS · M CuS = 96x г
m H2S = n H2S · M H2S = 34x г
mпрореаг. CuSO4 = nпрореаг. CuSO4 · M CuSO4 = 160x г
ωост. CuSO4 = (m CuSO4 – mпрореаг. CuSO4) / (mр-ра CuSO4 + m H2S – m CuS)
0,0215 = (48 – 160x) / (240 + 34x – 96x)
x = 0,27
nпрореаг. CuSO4 = n CuS = n H2S = n H2SO4 = 0,27 моль
4. Найдем число моль оставшегося сульфата меди(II):
nост. CuSO4 = n CuSO4 – nпрореаг. CuSO4 = 0,3 – 0,27 = 0,03 моль
5. Найдем число моль гидроксида натрия в исходном растворе:
m NaOH = mр-ра NaOH · ω NaOH = 128 · 0,25 = 32 г
n NaOH = m NaOH / M NaOH = 32 / 40 = 0,8 моль
6. Найдем массу конечного раствора:
mконечн. р-ра = mр-ра CuSO4 + m H2S + mр-ра NaOH – m CuS – m Cu(OH)2
m H2S = n H2S · M H2S = 0,27 · 34 = 9,18 г
m CuS = n CuS · M CuS = 0,27 · 96 = 25,92 г
n Cu(OH)2 = nост. CuSO4 = 0,03 моль
m Cu(OH)2 = n Cu(OH)2 · M Cu(OH)2 = 0,03 · 98 = 2,94 г
mконечн. р-ра = 240 + 9,18 + 128 – 25,92 – 2,94 = 348,32 г
7. Найдем массовую долю гидроксида натрия в конечном растворе:
n2 NaOH = 2nост. CuSO4 = 2 · 0,03 = 0,06 моль
n3 NaOH = 2n H2SO4 = 2 · 0,27 = 0,54 моль
nост. NaOH = n NaOH – n2 NaOH – n3 NaOH = 0,8 – 0,06 – 0,54 = 0,2 моль
mост. NaOH = nост. NaOH · M NaOH = 0,2 · 40 = 8 г
ωост. NaOH = mост. NaOH / mконечн. р-ра = 8 / 348,32 = 0,023 → 2,3%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||