Задание № 18153
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта.
На основании данных условия задачи:
1. произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. запишите молекулярную формулу органического вещества;
3. составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
Элементы ответа:
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
n(CO2) = 28 / 22,4 = 1,25 моль
n(H2O) = 22,5 / 18 = 1,25 моль
M(CxHyOz) = 3,125 x 22,4 = 70 г/моль
n(CxHyOz) = 17,5 / 70 = 0,25 моль
2) Определена молекулярная формула вещества:
n(C) = n(CO2) = 1,25 моль
n(H) = 2n(H2) = 2,5 моль
х = n(C) / n(CxHyOz) = 1,25 / 0,25 = 5
y = n(H) / n(CxHyOz) = 2,5 / 0,25 = 10
5 x 12 + 10 + z x 16 = 70
z = 0
Молекулярная формула вещества - C5H10
3) Составлена структурная формула вещества:
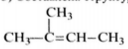
4) Составлено уравнение реакции получения вещества из третичного спирта:
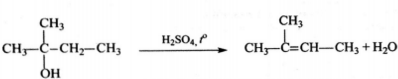
Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.