Вариант 19
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
1. K
2. Zn
3. Si
4. Ca
5. C
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их восстановительных свойств.
1) Cu
2) Cl
3) Zn
4) Si
5) P
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях с водородом проявляют валентность I.
1) P
2) Na
3) Cl
4) Mn
5) S
Из предложенного перечня выберите два легколетучих вещества.
1) Карбид кремния
2) Хлорид натрия
3) Хлорид фосфора (III)
4) Оксид кремния (IV)
5) Этанол
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислотного оксида металла, Б) амфотерного гидроксида, В) несолеобразующего оксида.
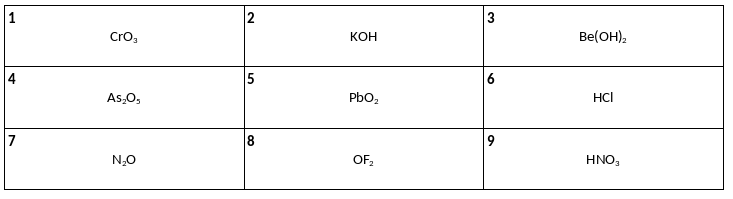
К одной из пробирок, содержащих раствор хлорида цинка, добавили избыток раствора вещества Х, а к другой – избыток раствора соединения натрия Y. В результате в каждой пробирке наблюдалось только выпадение белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NH4Br
2) NaOH
3) AgNO3
4) Na2S
5) СO2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Si
Б) NH3
В) HNO3
Г) Na2SiO3
РЕАГЕНТЫ
1) O2, CuO, H3PO4
2) HCl, Вa(NO3)2, MgSO4
3) NaOH, Mg, Cl2
4) P, Na2CO3, Cu
5) CO2, NaOH, BaCl2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Р (красн.)
Б) P2O3
В) Sn(OH)2
Г) BaBr2
РЕАГЕНТЫ
1) Na3PO4, Cl2, AgNO3
2) СO2, Н2O, NaOH
3) Са, Cl2, NO2
4) HBr, Ва(ОН)2, SO3
5) HNO3, Н2O, КОН
Задана следующая схема превращений веществ:
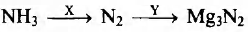
Определите, какие из указанных веществ являются веществами X и Y.
1. CuO
2. Al2O3
3. MgO
4. HNO3 (разб.)
5. Mg
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) изопропилбензол
Б) глицерин
В) бутанон
КЛАСС/ГРУППА
1) спирты
2) фенолы
3) кетоны
4) углеводороды
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентена-1.
1. циклопентен
2. пентан
3. пентин-1
4. циклопентан
5. метилбутен-1
Из предложенного перечня выберите все исходные вещества, в результате взаимодействия которых образуется толуол.
1) C6H6 и CH4
2) C6H6 и CH3Cl
3) C6H5Cl, CH3Cl и Na
4) C6H5OH и H2
5) C6H5Cl и Na
Из предложенного перечня выберите два вещества, с которыми взаимодействует диэтиламин.
1) Na
2) КОН
3) HNO3
4) O2
5) Н2
Установите соответствие между названием реакции и её преимущественным продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ РЕАКЦИИ
А) дегидрирование бутана
Б) гидратация пропина
В) гидрирование пропена
Г) изомеризация бутана
ПРОДУКТ РЕАКЦИИ
1) 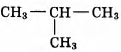
2) 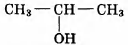
3) CH2=СН—СН=CH2
4) 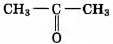
5) СН3 —СН2 —СН3
6) 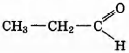
Установите соответствие между схемой реакции и реагентом X, который принимает в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) CH2O 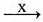 CO2
CO2
Б) CH3CHO 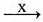 CH3COOH
CH3COOH
В) C2H5OH 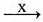 CH3COOH
CH3COOH
Г) C2H5OH 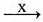 C2H5OC2H5
C2H5OC2H5
РЕАГЕНТ X
1) KMnO4 (H+)
2) CuO
3) NaOH
4) AlCl3
5) H2SO4 (разб.)
6) H2SO4 (конц.)
Задана следующая схема превращений веществ:
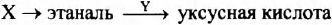
Определите, какие из указанных веществ являются веществами X и Y.
1. этан
2. 1,2-дихлорэтан
3. ацетилен
4. К2Сr2O7 (Н+)
5. СuО(t°)
Из предложенного перечня выберите все обратимые реакции.
1. H2S + 2NaOH = Na2S + 2H2O
2. CH4 + 2O2 = CO2 + 2H2O
3. N2 + 3H2 = 2NH3
4. S + O2 = SO2
5. 2SO2 + O2 = 2SO3
Из предложенного перечня выберите все воздействия, которые уменьшают скорость реакции:
CaCO3 + 2H+ = Ca2+ + CO2 + H2O + Q
1. Разбавление реакционной смеси водой
2. Понижение давления
3. Увеличение площади поверхности реагирующих веществ
4. Замена азотной кислоты на фтороводородную такой же концентрации
5. Понижение температуры
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) NH3 + H2O2 → N2 + H2O
Б) Br2 + KOH → KBr + KBrO3 + H2O
В) NH4NO3→ N2O + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) –3 → 0
2) –3 → +1
3) –1 → +1
4) 0 → +5
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) K2SO4
Б) CaBr2
В) CuCl2
Г) AgNO3
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и азот
2) водород и галоген
3) металл и галоген
4) металл и кислород
5) водород и кислород

Вещества, приведенные в перечне, растворили в воде и получили растворы с одинаковой молярной (моль/л) концентрацией веществ. Определите характер среды полученных растворов. Запишите номера веществ в порядке убывания значения pH растворов, полученных при внесении данных веществ в воду.
1) Бромид натрия
2) Сульфид калия
3) Сульфат магния
4) Дихромовая кислота
Установите соответствие между способом воздействия на равновесную систему
СО(г) + Сl2(г) ⇆ СОСl2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) уменьшение концентрации оксида углерода(II)
Б) уменьшение концентрации хлора
В) увеличение давления
Г) увеличение температуры
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество оксида серы(VI). В результате протекания обратимой реакции 2SO3 (г.) ⇋ 2SO2 (г.) + O2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида серы(VI) и оксида серы(IV) составили 0,05 моль/л и 0,20 моль/л соответственно. Определите исходную концентрацию SO3 (X) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,10 моль/л
3) 0,15 моль/л
4) 0,20 моль/л
5) 0,25 моль/л
6) 0,30 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно их различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) СН4 и С2Н2
Б) С2Н5ОН и СбН5ОН (р-р)
В) С2Н5ОН и СН3СООН
Г) С2Н4 и C3H8
РЕАГЕНТ
1) FeCl3 (р-р)
2) КМnО4 (р-р)
3) NaHCO3
4) NaCl
5) H2SO4
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) водород
Б) пропан
В) дивинил
Г) изопрен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение лавсана
2) в качестве топлива
3) получение каучука
4) получение аммиака
5) производство стали
Вычислите массу сульфата магния (в граммах), которую следует растворить в 250 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 15%.
Ответ:___________________г.
(Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж,
выделилось 242 кДж теплоты. Вычислите объём сгоревшего при этом водорода (в литрах, н.у.).
Ответ:___________________л.
(Запишите число с точностью до десятых.)
При взаимодействии избытка этилового спирта с 18,4 г натрия с выходом 90% был получен этилат натрия. Определите массу полученного продукта (г). (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Силикат натрия, нитрит калия, дихромат калия, серная кислота, йодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется простое вещество и две соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
2) Указан электронный баланс
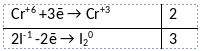
3) Указано, что хром в степени окисления +6 (дихромат калия) является окислителем, а иод в степени окисления -1 (иодид калия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4
2) Написано полное ионное уравнение:
2Na+ + SiO32- + 2H+ + SO42- = H2SiO3 + 2Na+ + SO42-
3) Написано сокращённое ионное уравнение:
SiO32- + 2H+ = H2SiO3Металлический хром растворили в соляной кислоте, при этом образовался голубой раствор, окраска которого довольно быстро изменилась на зелёную. После добавления раствора кальцинированной соды выпал серо-зелёный осадок, который отфильтровали и обработали в сильнощелочной среде бромной водой. Получили раствор жёлтого цвета. Напишите уравнения четырёх описанных реакций.
1) Cr + 2HCl = CrCl2 + H2 ↑
2) 4СrСl2 + 4HCl + O2 = 4CrCl3 + 2H2O
3) 2CrCl3 + 3Na2CO3 + 3H2O = 2Сг(ОН)3↓ + 3CO2↑ + 6NaCl
4) 2Cr(OH)3 + 10КОН + 3Br2 = 2К2СrO4 + 6KBr + 8H2O
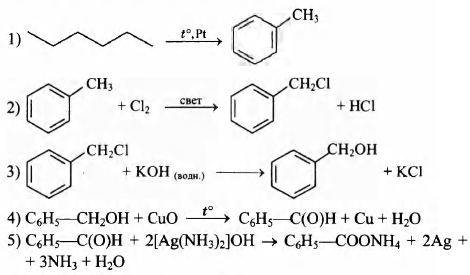
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
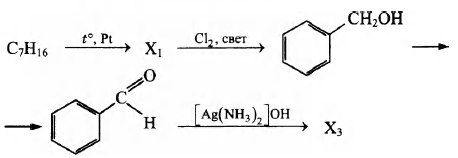
При написании уравнений реакций используйте структурные формулы органических веществ.
Некоторое органическое вещество, содержащее по массе 26,7% кислорода, 13,3% водорода, остальное — углерод, реагирует с натрием и окисляется оксидом меди(II) с образованием альдегида.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение взаимодействия данного вещества с натрием.
2) молекулярная формула вещества C3HgO
3) структурная формула СН3—СН2—СН2—ОН
4) уравнение реакции 2СН3—СН2—СН2—ОН + 2Na → 2СН3—СН2—СН2—ONa + Н2
К 218 г раствора гидроксида калия, в котором в общей сложности содержится 1,806 ∙ 1025 атомов, добавили 10,8 г алюминия. Через образовавшийся раствор пропустили сернистый газ, при этом прореагировало 22,4 л (н.у.) газа. Вычислите массовую долю соли в конечном растворе.
Элементы ответа:
Записаны уравнения реакций:
1) 2Al + 2KOH + 6H2O = K[Al(OH)4] + 3H2
2) K[Al(OH)4] + SO2 = Al(OH)3 + KHSO3
3) KOH + SO2 = KHSO3
Раствор гидроксида калия состоит из самого гидроксида калия и воды.
Пусть n(KOH) = x моль, n(H2O) = у моль
n(атомов) = 1,806 * 1025 / 6,02 * 1023 = 30 моль
Составим первое уравнение системы:
3х + 3у = 30
Масса раствора является суммой масс составляющих ее компонентов:
56х + 18у = 218
Это второе уравнение системы. Решая ее, находим переменные:
х = 1 моль, у = 9 моль
n(Al) = 10,8 / 27 = 0,4 моль
Алюминий в недостатке, после реакции в растворе осталось 0,4 моль соли и 0,6 моль щелочи.
Итого в растворе оказалось 0,4 + 0,6 = 1 моль сульфита калия.
Найдем массу раствора:
mр-ра = 218 + 10,8 + 64 - 0,6 * 2 - 78 * 0,4 = 260,4 г
m(KHSO3) = 120 * 1 = 120 г
w(KHSO3) = 120 / 260,4 = 0,4608 (46,08%)
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||