Вариант 11
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Два неспаренных электрона на внешнем уровне в основном состоянии имеют атомы:
1. Mg
2. C
3. O
4. Fe
5. Cl
Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Cl
2) Zn
3) N
4) S
5) Mg
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в бинарных соединениях переменную валентность. Запишите в поле ответа номера выбранных элементов.
1) F
2) P
3) Li
4) C
5) Zn
Из предложенного перечня веществ выберите два вещества, которые имеют ионное строение.
1) Серная кислота
2) Хлорид метиламмония
3) Оксид кремния (IV)
4) Фенолят калия
5) Хлороводород
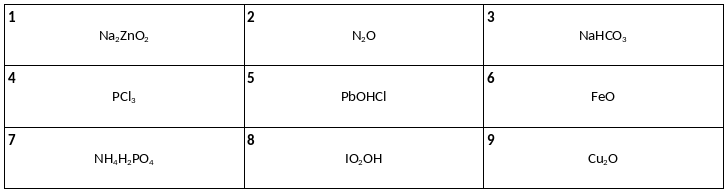
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислоты, Б) средней соли, В) несолеобразующего оксида.
Даны две пробирки с раствором сильного электролита Х. В одну из них добавили раствор хлорида кальция, а в другую — раствор сильной кислоты Y. При этом в каждой пробирке наблюдали выпадение осадка. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) HF
2) КЗРО4
3) Сu(ОН)2
4) Na2SiO3
5) HNO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) CO
Б) Cl2
В) K2[Zn(OH)4] (р-р)
Г) Fe2(SO4)3 (р-р)
РЕАГЕНТЫ
1) KOH, Na2CO3 (р-р), KI
2) HCl, ZnSO4, CO2
3) BaCl2, HNO3, N2
4) Na2O2, Fe3O4, O2
5) H2SO4, NaOH, CO2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Zn(OH)2
Б) H2SO4 (разб.)
В) H2S
Г) Са
РЕАГЕНТЫ
1) LiOH, НNО3, НСl
2) NaOH, К2O, CuSO4.
3) H2O, S, HNO3
4) Zn, ВаСl2, NaHS
5) NaNO3, CuO, SiO2
Задана следующая схема превращений веществ:
LiX→LiOHY→LiCl
Определите, какие из указанных веществ являются веществами X и Y.
1. KCl(p-p)
2. Cu(OH)2
3. CuCl2 (р-р)
4. AgCI
5. Н2O
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) пропен
Б) изопрен
В) ацетилен
КЛАСС/ГРУППА
1) арены
2) алкены
3) алкины
4) алкадиены
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пропановой кислоты.
1. этиловый эфир муравьиной кислоты
2. пропанол-1
3. метилацетат
4. пропаналь
5. метилэтиловый эфир
Из предложенного перечня выберите все вещества, при взаимодействии каждого из которых с водой в присутствии катализатора образуется кетон.
1) этин
2) пропин
3) пропилен
4) бутен-2
5) бутин-1
Из предложенного перечня выберите два вещества, с которыми реагирует анилин.
1. пропан
2. метан
3. бром
4. гидроксид натрия
5. соляная кислота
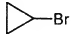
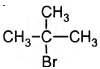
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обо знаменной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) этан
Б) изобутан
В) циклопропан
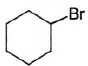
Г) циклогексан
ПРОДУКТ БРОМИРОВАНИЯ
1) 
2) 
3) Вr-СН2-СН2-СН2-Вr
4) 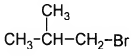
5) СН3-СН2-Вr
6) 
Установите соответствие между схемой реакции и веществом X, которое является одним из реагентов в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) фенол + X → фенолят калия
Б) муравьиная кислота + X → этилформиат
В) метаналь + X → углекислый газ
Г) этанол + X → этилат калия
ВЕЩЕСТВО X
1) СН3ОН
2) СuО
3) КМnО4(H+)
4) СН3СН2ОН
5) КНСО3
6) K
Задана следующая схема превращений веществ:
CH3CHCl2X→CH≡CHY→CH3CHO
Определите, какие из указанных веществ являются веществами X и Y.
1. H2O (Hg2+)
2. Zn
3. Cu(OH)2
4. NaOH (H2O)
5. NaOH (спирт)
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие цинка и серы.
1. гомогенная
2. соединения
3. каталитическая
4. гетерогенная
5. окислительно-восстановительная
Из предложенного перечня выберите все верные утверждения о скорости реакции, протекающей между серной кислотой и железом:
1. Если при 20°С концентрацию кислоты понизить с 98% до 20%, то реакция ускорится
2. Давление не влияет на скорость этой реакции
3. Если температуру повысить, то скорость реакции уменьшится
4. Добавление индикатора позволит существенно понизить скорость реакции
5. Если концентрацию кислоты повысить с 5% до 10%, то реакция ускорится
Установите соответствие между схемой реакции и значением степени окисления восстановителя в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) NaIO → NaI + NaIO3
Б) HI + H2O2 → I2 + H2O
В) NaIO3 → NaI + O2
СТЕПЕНЬ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) -2
2) -1
3) 0
4) +1
5) +5
Установите соответствие между формулой соли и продуктами электролита её водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) CuSO4
Б) KNO3
В) CuBr2
Г) LiCl
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) водород и галоген
4) металл и галоген
5) металл и водород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Нитрат алюминия
2) Акрилат лития
3) Хлорат рубидия
4) Гидроксид бария
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) N2(г) + 3H2(г) ⇄ 2NH3(г) + Q
Б) N2O4(г) ⇄ 2NO2(г) - Q
В) CO2(г) + H2(г) ⇄ CO(г) + H2O(г) - Q
Г) 4HCl(г) + O2 ⇄ 2H2O(г) + 2Cl2(г) + Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону продуктов реакции
2) смещается в сторону исходных веществ
3) смещение равновесия не происходит
В реактор постоянного объёма поместили водород и пары иода. При этом исходная концентрация паров иода составляла 0,9 моль/л. В результате протекания обратимой реакции H2 (г.) + I2 (г.) ⇋ 2HI (г.) в реакционной системе установилось химическое равновесие, при котором концентрации водорода и паров иода составили 0,2 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию HI (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЯ ВЕЩЕСТВ
А) этанол-1 и фенол (р-р)
Б) крахмал и сахароза(кр.)
В) пропанол-2 и глицерин
Г) толуол и бензол
РЕАКТИВ
1) NaMnO4 (р-р)
2) ZnO
3) Br2 (водн.)
4) Сu(ОН)2
5) I2(р-р)
Установите соответствие между процессом и аппаратом, в котором он протекает: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОЦЕСС
А) получение сернистого газа из пирита
Б) окисление оксида серы(IV)
В) очистка сернистого газа от оставшихся мелких частиц пыли
Г) получение серной кислоты из оксида серы(VI)
АППАРАТ
1) поглотительная башня
2) контактный аппарат
3) аппарат «Циклон»
4) электрофильтр
5) печь для обжига в «кипящем слое»
Смешали 400 г раствора с массовой долей азотной кислоты 25% и 200 г раствора с массовой долей этой кислоты 20%. Чему равна массовая доля кислоты в полученном растворе?
Ответ: ____________% (Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
С6Н12O6(тв.) + 6O2(г) = 6СО2(г) + 6Н2О(г) + 2800 кДж,
выделилось 560 кДж теплоты. Чему равно количество вещества кислорода, вступившего в реакцию?
Ответ: ________________ моль (Запишите число с точностью до десятых.)
При взаимодействии дивинила с избытком раствора брома образовалось 296,2 г тетрабромпроизводного. Определите массу (г) вступившего в реакцию дивинила, если выход этой реакции составил 88%. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется бесцветный раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) Написано уравнение реакции
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
2) Указан электронный баланс
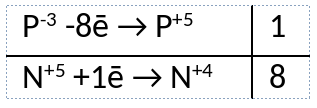
3) Указано, что азот в степени окисления +5 (азотная кислота) является окислителем, в фосфор в степени окисления -3 (фосфин) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. Реакция идёт без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2) Написано полное ионное уравнение:
2H+ + 2NO3- + Ba2+ + 2OH- = Ba2+ + 2NO3- + 2H2O
3) Написано сокращённое ионное уравнение:
H+ + OH- = H2O
Цинк полностью растворили в концентрированном растворе гидроксида калия. Образовавшийся прозрачный раствор выпарили, а затем прокалили. Твёрдый остаток растворили в необходимом количестве соляной кислоты. К образовавшемуся прозрачному раствору добавили сульфид аммония и наблюдали образование белого осадка. Напишите уравнения четырёх описанных реакций.
1)Zn+2KOH+2H2O=K2[Zn(OH)4]+H2↑
2)K2[Zn(OH)4]t∘→K2ZnO2+2H2O
2)K2ZnO2+4HCl=Zn2+2KCl+2H2O
4)ZnCI2+(NH4)2S=ZnS↓+2NH4CI
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
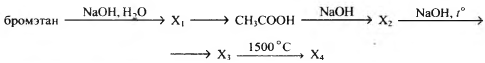
При написании уравнений реакций используйте структурные формулы органических веществ.
1)CH3−CH2−Br+NaOH→CH3−CH2−OH+NaBr
2)5CH3CH2OH+4KMnO4+6H2SO4t∘→
→5CH3COOH+4MnSO4+2K2SO4+11H2O
3)CH3COOH+NaOH→CH3COONa+H2O
4)CH3COONa+NaOHt∘→CH4+Na2CO3
5)2CH4t∘→CH≡CH+3H2
Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди(II).
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).
Общая формула вещества - CxHyOz
1) Найдено соотношение атомов углерода, водорода и кислорода в соединении:
w(H) = 100 - 40,0 - 53,3 = 6,7%
х : у : z = 40/12 : 6,7/1 : 53,3/16 = 3,33 : 6,7 : 3,33 = 1:2:1
2) Определена молекулярная формула вещества.
Простейшая формула вещества - СН2O. Учитывая то, что вещество реагирует с оксидом меди(II), молекулярная формула вещества - С2Н4O2
3) Составлена структурная формула вещества:
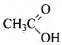
4) Составлено уравнение реакции с оксидом меди(II):
2СН3СООН + СuО → (СН3СОО) 2Сu + Н2O
Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
Элементы ответа:
Записаны уравнения реакций:
(1) AlCl3 + 3AgNO3 = 3AgCl ↓ + Al(NO3)3
(2) AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
(возможно образование Na3[Al(OH)6])
Рассчитаны количество вещества реагентов и продуктов реакций:
m(AlCl3) = 767 • 53,4 / (100 + 53,4) = 267 г
n(AlCl3) = 267 / 133,5 = 2 моль
n(AgCl) = 344,4 / 143,5 = 2,4 моль
n1(AlCl3) = 1/3n(AgCl) = 0,8 моль
n2(AlCl3) = 2 − 0,8 = 1,2 моль
m(NaOH) = 960 • 0,4 = 384 г
n(NaOH) = 384 / 40 = 9,6 моль — избыток
n(NaCl) = 3n2(AlCl3) = 3,6 моль
m(NaCl) = 3,6 • 58,5 = 210,6 г
Вычислена массовая доля хлорида натрия в растворе:
m(р-ра AlCl3) = 767 • 1,2 / 2 = 460,2 г (во второй колбе)
m(конечног р-ра) = 460,2 + 960 = 1420,2 г
ω(NaCl) = 210,6 / 1420,2 = 0,148, или 14,8%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||