Вариант 9
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Возбуждённому состоянию отвечают электронные конфигурации:
1. 1s22s22p2
2. 1s22s22p63s13p3
3. 1s22s22p63s23p64s2
4. 1s22s22p63s23p44s1
5. 1s22s22p63s23p63d64s2
Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотных свойств соответствующих водородных соединений.
1) I
2) N
3) Mn
4) Ne
5) F
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую валентность, равную IV. Запишите в поле ответа номера выбранных элементов.
1) K
2) N
3) Ca
4) C
5) Cr
Из предложенного перечня выберите два вещества ионного строения, в которых присутствуют ковалентные неполярные связи.
1) Хлорид аммония
2) Карбид кальция
3) Пероксид водорода
4) Оксалат калия
5) Бензойная кислота
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) нестабильной кислоты, Б) основного оксида, В) оснóвной соли.
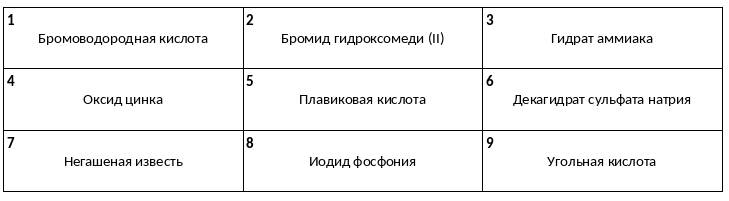
Даны две пробирки с раствором бромоводорода. В первую пробирку добавили раствор вещества Х, а во вторую — раствор вещества Y. В результате в первой пробирке образовался осадок, а во второй пробирке выделился газ. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) силикат натрия
2) гидросульфат калия
3) иодид серебра
4) гидрокарбонат калия
5) гидроксид бария
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) C
Б) NH3
В) NaHSO4
Г) KF
РЕАГЕНТЫ
1) LiOH, BaCl2, H2SO4 (конц)
2) NaOH, Mg, BaCl2
3) O2, CH3COOH, AlCl3 (р-р)
4) Fe2O3, BaSO4, S
5) CaF2, Br2, PH3
Установите соответствие между исходными веществами и продуктами их взаимодействия.
ИСХОДНЫЕ ВЕЩЕСТВА
А) NaOH + I2
Б) I2 + Вr2
В) NaOH + NO2
Г) NaOH + NO + NO2
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) Nal + Н2O + O2
2) BrI3
3) IВr3
4) NaNO2 + Н2O
5) NaNO2 + NaNO3 + Н2O
6) Nal + Н2O + NaIO3
В заданной схеме превращений
P2O5X→Ca3(PO4)2Y→Ca(H2PO4)2
веществами X и Y соответственно являются:
1. Ca
2. Ca3N2
3. Ca(OH)2
4. H2O
5. H2SO4
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) этиленгликоль
Б) глицин
В) анилин
КЛАСС/ГРУППА
1) амин
2) спирт
3) альдегид
4) аминокислота
Одинаковые функциональные группы содержат:
1. бутанол-1 и бутанон
2. глицерин и бутанол-2
3. анилин и пропин
4. метиламин и 2-аминобутан
5. пропанол-2 и пропилацетат
Из предложенного перечня выберите все вещества, которые вступают в реакцию гидрохлорирования.
1) этан
2) толуол
3) изопрен
4) бензол
5) циклогексан
Сахароза, в отличие от глюкозы
1. реагирует с Сu(ОН)2
2. растворима в воде
3. реагирует с метанолом
4. относится к дисахаридам
5. реагирует с водой
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этан и азотная кислота
Б) этан и соляная кислота
В) этан и хлор
Г) бутан и АlСl3
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бутен
2) изобутан
3) нитроэтан
4) хлорэтан
5) 1,2-дихлорэтан
6) взаимодействие невозможно
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ацетон и водород
Б) пропен и вода
В) пропаналь и водород
Г) пропионовая кислота и натрий
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропанол-1
2) пропанол-2
3) пропанон
4) пропановая кислота
5) пропионат натрия
6) пропилат натрия
В заданной схеме превращений
C2H5OHX→C6H5COOC2H5Y→C6H5COOH
веществами X и Y соответственно являются:
1. C6H5OH
2. C6H5COOH
3. KOH
4. CO2
5. H2O
Из предложенного перечня выберите все гетерогенные реакции.
1. Fe(тв.) + S(тв.) = FeS(тв.)
2. CH4(г.) + 2O2(г.) = CO2(г.) + 2H2O(ж.)
3. NaOH(р-р.) + HCl(р-р.) = NaCl(р-р.) + H2O(ж.)
4. HCOOH(ж.) + CH3OH(ж.) = HCOOCH3(ж.) + H2O(ж.)
5. CaO(тв.) + 2HCl(р-р.) = CaCl2(р-р.) + H2O(ж.)
Из предложенного перечня выберите все факторы, которые приведут к увеличению скорости реакции между алюминием и раствором гидроксида натрия:
1. Повышение давления
2. Измельчение алюминия
3. Повышение концентрации ионов алюминия
4. Добавление твердого гидроксида натрия
5. Нагревание реакционного сосуда
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) O2 + N2 = 2NO
Б) 4NH3 + 5O2 = 4NO + 6H2O
В) NH3 + HF = NH4F
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА
А) К2СO3
Б) AgNO3
В) ZnCl2
Г) NaHCO3
АНОДНЫЙ ПРОДУКТ
1) кислород
2) металл
3) водород
4) азот
5) углекислый газ
6) хлор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Фосфат натрия
2) Бромид калия
3) Хлорид метиламмония
4) Гидроксид лития
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) N2 + 3H2(г) ⇄ 2NH3(г)
Б) 2H2(г) + O2(г) ⇄ 2H2O(г)
В) 2HCl(г) ⇄ H2(г) + Cl2(г)
Г) SO2Br2(г) ⇄ SO2(г) + Br2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили пропан и водород. При этом исходные концентрации пропана и водорода составляли 0,30 моль/л и 0,50 моль/л соответственно. В результате протекания обратимой реакции C3H8 (г.) + 2H2 (г.) ⇋ 3CH4 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация пропана составила 0,15 моль/л. Определите равновесные концентрации H2 (X) и CH4 (Y).
Выберите из списка номера правильных ответов.
1) 0,20 моль/л
2) 0,25 моль/л
3) 0,30 моль/л
4) 0,35 моль/л
5) 0,40 моль/л
6) 0,45 моль/л
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) пентанол и фенол
Б) пропанол-1 и глицерин
В) муравьиная кислота и уксусная кислота
Г) стеариновая и олеиновая кислоты
РЕАГЕНТ
1) бромная вода
2) аммиачный р-р оксида серебра(I)
3) раствор соды
4) гидроксид меди(II)
5) натрий
Примерами гидрометаллургических процессов могут быть реакции:
1. Cu(NO3)2 + Fe = Сu + Fe(NO3)2
2. СаСl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
3. 2AgNO3 = 2Ag + 2NO2 + O2
4. Cr2O3 + 2Al = Al2O3 + 2Cr
5. Zn + 2[Ag(NH3)2]OH = 2Ag + [Zn(NH3)4](OH)2
Смешали 200 г 11%-ного раствора нашатыря и 350 г 17%-ного раствора этой же соли. Какова массовая доля нашатыря в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: ___________________%.
В результате реакции, термохимическое уравнение которой
2Н2(г) + O2(г) = 2Н2O(г) + 484 кДж,
выделилось 968 кДж теплоты. Вычислите объём (н.у.) водорода, вступившего в реакцию. (Запишите число с точностью до десятых.)
Ответ: ___________________л.
При взаимодействии загрязнённого образца гидрокарбоната калия с гидроксидом калия образовалось 372,6 г средней соли. Определите массу (г) указанного образца, если известно, что массовая доля посторонних примесей составляет 5%. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Гипохлорит натрия, хлорид хрома(II), гидроксид натрия, нитрат серебра, нитрит натрия, соляная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется жёлтый раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) Написано уравнение реакции
CrCl2 + 2NaClO + 4NaOH = Na2CrO4 + 4NaCl + 2H2O
2) Указан электронный баланс
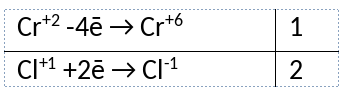
3) Указано, что хлор в степени окисления +1 (гипохлорит натрия) является окислителем, а хром в степени окисления +2 (хлорид хрома(II)) является восстановителем.
Из предложенного перечня веществ выберите соль и вещество, которое вступает с ней в реакцию ионного обмена. Реакция протекает без выделения газа и выпадения осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
NaNO2 + HCl = NaCl + HNO2
2) Написано полное ионное уравнение:
Na+ + NO2- + H+ + Cl- = Na+ + Cl- + HNO2
3) Написано сокращённое ионное уравнение:
NO2- + H+ = HNO2
Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком концентрированного раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка.
Запишите уравнения описанных реакций.
1) 2AI + 3S 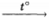 Al2S3
Al2S3
2) Al2S3 + 6H2O = 2Al(OH3) ↓ + 3H2S ↑
3) Al(OH)3 + KOH = K[Al(OH)4] (допустимо образование K3[Al(OH)6])
4) 3K[Al(OH)4] + AlCl3 = 3KCl + 4Al(OH)3 ↓
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CaCO3 → CaC2 → X1 → Ag2C2 → X1 → винилацетилин
При написании уравнений реакции используйте структурные формулы органических соединений.
1) CaCO3+4Ct∘→CaC2+3CO
2) CaC2+2H2O→Ca(OH)2+HC≡CH↑
3) HC≡CH+2[Ag(NH3)2]OH→AgC≡CAg↓+4NH3+2H2O
4) AgC≡CAg+2HCl→HC≡CH↑+2AgCl↓
5) 2HC≡kam.→H2C=CH−C≡CH
Некоторое органическое соединение массой 5,8 г, взаимодействуя с гидроксидом меди (II), при нагревании образовало 14,4 г осадка oксида меди (I). Указанное органическое соединение вступает в реакции присоединения гидросульфита натрия и этанола. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с гидроксидом меди (II).
2) молекулярная форму C3H6O
3) структурная формула
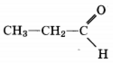
4) уравнение реакции C2H5C(O)H + 2Cu(OH)2 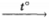 C2H5COOH + Cu2O + 2H2O
C2H5COOH + Cu2O + 2H2O
Хлорид фосфора (V) смешали с водой в массовом соотношении 1 : 10. К полученному раствору добавили раствор гидроксида лития. При этом образовалось 850 г раствора с массовой долей единственного растворенного вещества 5%. Вычислите массовую долю гидроксида лития в добавленном растворе.
Элементы ответа:
Записаны уравнения реакций:
(1) PCl5 + 4H2O = H3PO4 + 5HCl
(2) HCl + LiOH = LiCl + H2O
(2) H3PO4 + 3LiOH = Li3PO4 ↓ + 3H2O
Вычислено количество исходных веществ
m(LiCl) = m(p-pa) • ω = 850 • 0,05 = 42,5 г
n(LiCl) = m : M = 42,5 : 42,5 = 1 моль
n(PCl5) = n(LiCl) : 5 = 0,2 моль
m(PCl5) = n • M = 0,2 • 208,5 = 41,7 г
m(H2O) = 10 • 41,7 = 417 г
n(Li3PO4) = n(PCl5) = 0,2 моль
n(LiOH) = n(LiCl) + n(PCl5) • 3 = 1 + 0,2 • 3 = 1,6 моль
m(Li3PO4) = n • M = 0,2 • 116 = 23,2 г
Вычислена масса раствора гидроксида лития
m(конеч. р-ра) = m(PCl5) + m(H2O) + mp-pa(LiOH) − m(Li3PO4) = 850г
m(конеч. р-ра) = 41,7 + 417 + mp-pa(LiOH) − 23,2 = 850 г
mp-pa(LiOH) = 850 − 41,7 − 417 + 23,2 = 414,5 г
Вычислена массовая доля гидроксида лития в добавленном растворе
m(LiOH) = n • M = 1,6 • 24 = 38,4 г
ω(LiOH) = 38,4 : 414,5 • 100% = 9,26%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||