Вариант 5
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Восьмиэлектронную внешнюю оболочку в основном состоянии имеют частицы:
1. Al3+
2. C2+
3. S2-
4. F
5. Cl5+
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания кислотных свойств их высших оксидов.
1) С
2) Mg
3) Mn
4) P
5) Cl
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
1) Cl
2) Zn
3) N
4) S
5) Mg
Из предложенного перечня выберите два вещества ионного строения, в которых присутствует связь, образованная по донорно-акцепторному механизму.
1)Азотная кислота
2)Хлорид аммония
3)Тетрагидроксоцинкат калия
4)Ацетат натрия
5)Аммиак
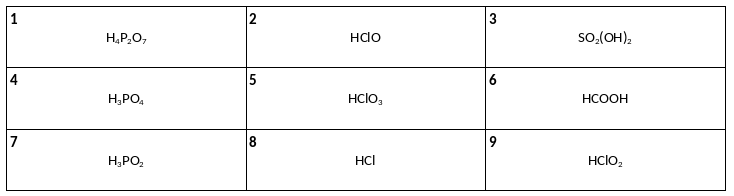
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) четырехосновной кислоты, Б) двухосновной кислоты, В) трехосновной кислоты.
Даны две пробирки с раствором гидрокарбоната натрия. В первую пробирку добавили раствор вещества Х и наблюдали выделение газа. Во вторую пробирку добавили раствор вещества Y. В этой пробирке произошла реакция, которую описывает сокращённое ионное уравнение
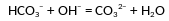
Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) хлороводород
2) аммиак
3) гидроксид калия
4) гидроксид магния
5) гидроксид бария
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) HBr
Б) S
В) CO2
Г) FeO
РЕАГЕНТЫ
1) KOH, H2SO4 (конц), P
2) O2, H2SO4 (разб), H2
3) MnO2, NaHCO3 (тв), Fe
4) CaCO3 (взвесь), Na2[Zn(OH)4], H2O
5) HNO3, S, MgF2
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
ФОРМУЛЫ ВЕЩЕСТВ
А) Сr(ОН)3 + СsОН(водн. р-р)
Б) Cr(OH)3 + Cs2O 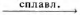
В) Сr(ОН)3 + КОН 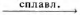
Г) Сr(ОН)3 + К2СO3 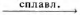
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) CsCrO2
2) Cs3[Cr(OH)6]
3) KCrO2
4) K3[Cr(OH)6]
В заданной схеме превращений
FeX→FeCl3Y→FeCl2
веществами X и Y соответственно являются:
1. HCl
2. Cl2
3. C
4. Fe
5. H2O
Установите соответствие между формулой органического соединения и его названием.
ФОРМУЛА СОЕДИНЕНИЯ
А) С2Н5—ОН
Б) С6Н5—СН=СН2
В) СН2(ОН)—СН(ОН)—СН2(ОН)
Г) СН2=С(СН3)—СН=СН2
НАЗВАНИЕ СОЕДИНЕНИЯ
1) дивинил
2) этанол
3) изопрен
4) глицерин
5) толуол
6) стирол
Атомы углерода только в sр3-гибридном состоянии находятся в молекулах
1. стирола
2. глицерина
3. пропанола-2
4. толуола
5. этаналя
Из предложенного перечня выберите все вещества, с которыми взаимодействует муравьиная кислота.
1) Cu(OH)2
2) CaSO4
3) [Ag(NH3)2]OH
4) C6H5–CH3
5) HO–CH2–CH2–OH
Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота.
1. уксусная кислота
2. аммиак
3. азот
4. изобутан
5. сульфат бария
Установите соответствие между веществом и продуктом его дегидрирования при нагревании с катализатором.
ВЕЩЕСТВО
А) циклогексан
Б) изобутан
В) гептан
Г) гексан
ПРОДУКТ ДЕГИДРИРОВАНИЯ
1) бензол
2) 2-метилпропен
3) циклогептан
4) гексен-2
5) бутадиен-1,2
6) толуол
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и оксид меди(II)
Б) пропанол-2 и оксид меди(II)
В) пропанол-2 и муравьиная кислота
Г) пропин и вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропаналь
2) ацетон
3) пропен
4) изопропанол
5) пропилацетат
6) изопропилформиат
В заданной схеме превращений
CH4X→CH3BrY→CH3NH2
веществами X и Y соответственно являются
1. НВг
2. Вr2
3. N2
4. NH3
5. NH4Br
Из предложенного перечня типов реакций выберите все типы реакции, к которым можно отнести взаимодействие серы и кислорода.
1. эндотермическая
2. гетерогенная
3. реакция соединения
4. каталитическая
5. окислительно-восстановительная
Из предложенного перечня выберите все воздействия, которые увеличивают скорость реакции, протекающей по схеме:
ZnO + 2H+ → Zn2+ + H2O + Q
1. Измельчение оксида цинка
2. Повышение давления
3. Замена соляной кислоты на уксусную такой же концентрации
4. Повышение температуры
5. Добавление индикатора
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) S + KOH → K2S + K2SO3 + H2O
Б) KI + KMnO4 + H2O → I2 +MnO2 + KOH
В) CaO + C → CaC2 + CO
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) 0 → -2
2) 0 → +4
3) -1 → 0
4) 0 → +2
Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА
А) NaNO3
Б) Cu(NO3)2
В) RbHCO3
Г) SnCl2
КАТОДНЫЙ ПРОДУКТ
1) кислород
2) только металл
3) только водород
4) металл и водород
5) азот
6) хлор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Нитрат ртути (II)
2) Иодид кальция
3) Гидроксид цезия
4) Бензоат калия
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе:
УРАВНЕНИЕ РЕАКЦИИ
А) SO2Cl2(г) ⇄ SO2(г) + Cl2(г)
Б) 2H2(г) + O2(г) \rightleftarrows 2H2O(г)
В) 2HCl(г) \rightleftarrows H2(г) + Cl2(г)
Г) N2(г) + 3H2(г) \rightleftarrows 2NH3(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество трифторида хлора. В результате протекания обратимой реакции 2ClF3 (г.) ⇋ Cl2 (г.) + 3F2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации фторида хлора(III) и хлора составили 0,1 моль/л и 0,2 моль/л соответственно. Определите исходную концентрацию ClF3 (X) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между реагирующими веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) этаналь и ацетон
Б) пропанол-1 и этиленгликоль
В) метиламин и пропан
Г) этанол и глицерин
РЕАГЕНТ
1) метилоранж (р-р)
2) Сu(ОН)2
3) Fe(OH)3
4) H2SO4 (р-р)
5) КСl
В качестве мономеров для синтеза высокомолекулярных соединений используют:
1. пропен
2. бутин-1
3. толуол
4. бутадиен-1,3
5. пентадиен-1,4
К 250 г 10%-ного раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Чему равна массовая доля нитрата натрия в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: ___________________%.
В результате реакции, термохимическое уравнение которой
2Н2(г) + О2(г) = 2Н2O(г) + 484 кДж,
выделилось 968 кДж теплоты. Вычислите массу образовавшейся при этом воды. (Запишите число с точностью до целых).
Ответ: ___________________г.
В результате взаимодействия бромида метиламмония массой 280 г с избытком гидроксида натрия был получен метиламин с выходом 80%. Определите объём (в литрах, н.у.) выделившегося амина. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: Азотная кислота, оксид меди(I), оксид марганца(IV), хлорид железа(III), сера, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется кислота и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
2) Указан электронный баланс
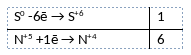
3) Указано, что сера в степени окисления 0 является восстановителем, а азот в степени окисления +5 (азотная кислота) является окислителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабая кислота. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
NH4F + HNO3 = HF + NH4NO3
2) Написано полное ионное уравнение:
NH4+ + F- + H+ + NO3- = HF + NH4+ + NO3-
3) Написано сокращённое ионное уравнение:
F- + H+ = HF
Натрий сожгли на воздухе. Образовавшееся вещество обработали хлороводородом. Полученное простое вещество при нагревании вступило в реакцию с оксидом хрома(III) в присутствии гидроксида калия. При обработке раствора одной из образовавшихся солей хлоридом бария выпал жёлтый осадок. Напишите уравнения четырёх описанных реакций.
1) 2Na+O_2=Na_2O_2
2) Na_2O_2+4HCl=2NaCl+Cl_2+2H_2O
3) Cr_2O_3+3Cl_2+10KOH\xrightarrow{t^\circ}2K_2CrO_4+6KCl+5H_2O
4) K_2CrO_4+BaCl_2=BaCrO_4\downarrow+2KCl
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
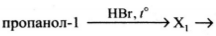
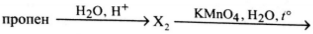
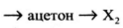
При написании уравнений реакций используйте структурные формулы органических веществ
1) CH_3-CH_2-CH_2-OH+HBr\rightarrow CH_3-CH_2-CH_2-Br+H_2O
2) CH_3-CH_2-CH_2-Br+KOH\xrightarrow{t^\circ}CH_3-CH=CH_2+H_2O+KBr
3) CH_3-CH=CH_2+H_2O\xrightarrow{H^+}CH_3-CH(OH)-CH_3
4) \begin{array}{l}3CH_3-CH(OH)-CH_3+2KMnO_4\xrightarrow{t^\circ}3CH_3-CO-CH_3+\\+2MnO_2+2KOH+2H_2O\end{array}
5) CH_3-CO-CH_3+H_2\rightarrow CH_3-CH(OH)-CH_3
При растворении пероксида лития Li2O2 в теплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объем углекислого газа (н.у.) может быть поглощен получившейся щелочью?
Элементы ответа:
1) Составлено уравнение реакции пероксида лития с водой, и рассчитано количество вещества пероксида лития:
2Li2O2 + 2H2O = 4LiOH + O2 ↑
m(Li2O2) = m / M = 2,3 / 46 = 0,05 моль
2) Рассчитаны количество вещества и масса гидроксида лития и кислорода:
n(LiOH) = 2n(Li2O2) = 0,1 моль
n(O2) = 0,5n(Li2O2) = 0,025 моль
m(LiOH) = 0,1 x 24 = 2,4 г
m(O2) = 0,025 x 32 = 0,8 г
3) Определена масса раствора, и рассчитана массовая доля гидроксида лития в нем:
m(p-pa) = 2,3 + 62 - 0,8 = 63,5 г
ω(LiOH) = 2,4 / 63,5 = 0,038 или 3,8%
4) Записано уравнение реакции избытка углекислого газа со щелочью, и найден объем углекислого газа:
LiOH + CO2 = LiHCO3
n(CO2) = n(LiOH) = 0,1 моль
V(CO2) = 0,1 x 22,4 = 2,24 л
Растворимость аммиака составляет 640 л (н. у.) на 1 л воды, а растворимость оксида серы (IV) — 40 л (н. у.) на 1 л воды. Смешали их насыщенные растворы, при этом вещества прореагировали полностью. К полученному раствору добавили раствор нитрата кальция. Масса конечного раствора составила 1 кг, а массовая доля единственного растворенного вещества составила 16%. Вычислите массовую долю нитрата кальция в добавленном растворе. (Образованием кислых солей пренебречь).
Элементы ответа:
Записаны уравнения реакций:
(1) 2NH3 + SO2 + H2O = (NH4)2SO3
(2) (NH4)2SO3 + Ca(NO3)2 = CaSO3↓ + 2NH4NO3
Вычислено количество исходных веществ
m(NH4NO3) = m(p-pa) · ω = 1000 · 0,16 = 160 г
n(NH4NO3) = m : M = 160 : 80 = 2 моль
n((NH4)2SO3) = n(Ca(NO3)2) = (CaSO3) = n(NH4NO3) : 2 = 2 : 2 = 1 моль
n(NH3) = n((NH4)2SO3) · 2 = 1 · 2 = 2 моль
n(SO2) = n((NH4)2SO3) = 1 моль
V(NH3) = VM · n = 22,4 · 2 = 44,8 л
V(SO2) = VM · n = 22,4 · 1 = 22,4 л
m(H2O) = 1000 · 1 = 1000 г
640 : 1000 = 44,8 : х
х = 70 г
mp-pa(NH3) = 70 + 17 · 2 = 104 г
40 : 1000 = 22,4 : y
y = 560 г
mp-pa(SO2) = 560 + 64 · 1 = 624 г
Вычислена масса раствора нитрата кальция
m(конеч. р-ра) = mp-pa(NH3) + mp-pa(SO2) + mp-pa(Ca(NO3)2) − m(CaSO3) = 1000 г
m(конеч. р-ра) = 624 + 104 + mp-pa(Ca(NO3)2) − 120 · 1 = 1000 г
mp-pa(Ca(NO3)2) = 1000 + 120 − 624 − 104 = 392 г
Вычислена массовая доля нитрата кальция в добавленном растворе
m(Ca(NO3)2) = n · M = 1 · 164 = 164 г
ω(Ca(NO3)2) = 164 : 392 · 100 % = 41,84 %
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||