Вариант 1
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Три электрона на внешнем уровне в основном состоянии имеют атомы элементов:
1. Al
2. B
3. N
4. As
5. Cr
Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения радиуса их атомов.
1) Ca
2) P
3) N
4) O
5) Ti
Из числа указанных в ряду элементов выберите два элемента, у каждого из которых разность между значениями их высшей и низшей степеней окисления равна 4.
1) Ca
2) P
3) N
4) O
5) Ti
Из предложенного перечня выберите два соединения, температура плавления которых ниже, чем у трех остальных.
1)SiO2
2)Al2O3
3)C6H5OH
4)KOH
5)H2SO4
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) двухосновной кислоты, Б) средней соли, В) амфотерного оксида.
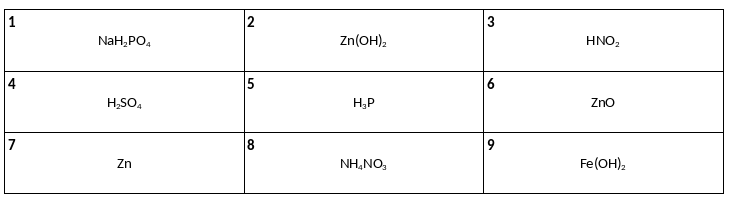
Даны две пробирки с раствором силиката калия. В первую пробирку добавили раствор вещества Х и в результате наблюдали образование осадка. Во вторую пробирку добавили раствор вещества Y, в результате образовался нерастворимый гидроксид. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) гидроксид меди(ІІ)
2) фосфат кальция
3) хлороводород
4) хлорид кальция
5) гидроксид натрия
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) ZnO
Б) H2SO4 (p-p)
В) K2CO3
Г) Ca(OH)2
РЕАГЕНТЫ
1) Fe, Al, Fe(OH)2
2) CaCl2, HNO3, Ba(OH)2
3) HBr, NaOH, H2SO4 (конц.)
4) Al(OH)3, Cl2, Na2CO3
5) HNO3 (p-p), O2, AgNO3
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
ФОРМУЛЫ ВЕЩЕСТВ
А) Сr + Сl2
Б) Сr + НСl
В) СrO3 + НСl
Г) К2Сr2O7 + НСl
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) CrCl2
2) CrCl3
3) CrCl4
4) CrCl5
5) CrCl6
В заданной схеме превращений
CO2X→CaCO3Y→CO2
веществами X и Y соответственно являются:
1. Ca
2. CaO
3. H2O
4. HCl
5. H2S
Установите соответствие между названием органического соединения и общей формулой его гомологического ряда.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) метилбензол
Б) 2,2-диметилпентан
В) циклогексен
Г) 1,1-диметилциклогексан
ОБЩАЯ ФОРМУЛА РЯДА
1) CnH2n + 2
2) CnH2n
3) CnH2n - 2
4) CnH2n - 4
5) CnH2n - 6
Изомерами пентена-2 являются
1. пентен-1
2. циклопентан
3. пентин-2
4. 2-метилпентен-2
5. метилциклопентан
Из предложенного перечня веществ выберите все вещества, при взаимодействии каждого из которых с водородом в присутствии катализатора образуется пропан.
1) пропилен
2) 2-хлорпропан
3) пропанол-1
4) метилпропан
5) циклопропан
Из предложенного перечня выберите два вещества, с которыми реагирует метиламин.
1. бутан
2. водород
3. кислород
4. соляная кислота
5. алюминий
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропан и бром
Б) циклопропан и бром
В) пропен и бромная вода
Г) пропин и бромная вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) 1-бромпропан
2) 2-бромпропан
3) 1,3-дибромпропан
4) 1,2-дибромпропан
5) 1.2-дибромпропен
6) бромциклопропан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и оксид меди(II)
Б) уксусная кислота и оксид меди(II)
В) этанол и натрий
Г) этанол и гидроксид натрия
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди(I)
2) ацетат меди(II)
3) этилат натрия
4) этилнатрий
5) этаналь
6) не взаимодействуют
В заданной схеме превращений
CH3−CH2−CH2−OHX→⋯Y→CH3−CH(OH)−CH3
веществами X и Y соответственно являются:
1. CuO
2. HBr
3. KOH(спиртов.)
4. H2O
5. H2SO4(конц.)
Из предложенного перечня типов реакций выберите все типы реакций, к которым можно отнести взаимодействие алюминия и серы.
1. Гомогенная
2. Реакция соединения
3. Реакция замещения
4. Окислительно-восстановительная
5. Обратимая
Из предложенного перечня выберите все воздействия, которые не повлияют на скорость реакции растворения железа в соляной кислоте:
1. Понижение концентрации ионов железа
2. Добавление воды в реакционную колбу
3. Изменение формы реакционного сосуда
4. Повышение давления
5. Пропускание через реакционную колбу газообразного хлороводорода
Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
A) C2H4 + H2 → C2H6
Б) HCOOH + Br2 → CO2 + HBr
В) NH4F + LiNO2 → N2 + LiF + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) от -3 до 0
2) от -2 до -3
3) от 0 до -1
4) от +3 до 0
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА
А) KI
Б) AgF
В) FeCl2
Г) KHCO3
АНОДНЫЙ ПРОДУКТ
1) кислород
2) металл
3) иод
4) фтор
5) углекислый газ
6) хлор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Нитрит натрия
2) Нитрат бария
3) Нитрат алюминия
4) Гидроксид бария
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
УРАВНЕНИЕ РЕАКЦИИ
А) S(г) + H2(г) ⇄ H2S(г)
Б) 2SO2(г) + O2(г) ⇄ 2SO3(г)
В) H2(г) + I2(тв.) ⇄ 2HI(г)
Г) SO2(г) + Cl2(г) ⇄ SO2Cl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили фторид азота(III). При этом его исходная концентрация составляла 0,8 моль/л. В результате протекания обратимой реакции 2NF3 (г.) ⇋ N2 (г.) + 3F2 (г.). в реакционной системе установилось химическое равновесие, при котором концентрация фтора составила 0,6 моль/л. Определите равновесные концентрации NF3 (X) и N2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) СаСl2 и NaCl
Б) Al(NO3)3 и Mg(NO3)2
В) Na2SO4 и ВаСl2
Г) КОН и КВr
РЕАГЕНТ
1) КОН
2) К2СO3
3) лакмус
4) HCl
5) AgCl
Чему равна массовая доля соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-ного раствора этой соли? (Запишите число с точностью до целых.)
Ответ: ___________________%.
В результате реакции, термохимическое уравнение которой
SO3(ж) + Н2O(ж) = H2SO4(ж) + 88 кДж,
выделилось 264 кДж теплоты. Вычислите массу образовавшейся при этом серной кислоты. (Запишите число с точностью до целых.)
Ответ: ____________________г.
Образец оксида меди(II), содержащий 15% примесей меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 352 г сульфата меди(II). Определите массу указанного образца (г). (запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Гидросульфид калия, нитрат натрия, перманганат калия, сульфит калия, гидроксид калия, ацетат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе этой реакции образуется два нерастворимых вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
3KHS + 2KMnO4 + H2O = 3S + 2MnO2 + 5KOH
2) Указан электронный баланс
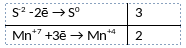
3) Указано, что сера в степени окисления -2 (или гидросульфид калия) является восстановителем, а марганец в степени окисления +7 (или перманганат калия) является окислителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе данной реакции образуется слабый электролит. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
KHS + KOH = K2S + H2O
2) Написано полное ионное уравнение:
2K+ + HS- + OH- = 2K+ + S2- + H2O
3) Написано сокращённое ионное уравнение:
HS- + OH- = H2O + S2-
Цинк полностью растворили в концентрированном растворе гидроксида калия. Образовавшийся прозрачный раствор выпарили, а затем прокалили. Твердый остаток растворили в необходимом количестве соляной кислоты. К образовавшемуся прозрачному раствору добавили сульфид аммония и наблюдали образование белого осадка. Напишите уравнение четырех описанных реакций.
Ответ включает в себя 4 уравнение возможных реакций, соответствующих описанным превращениям:
1) Zn+2KOH+2H2O=K2[Zn(OH)4]+H2↑
2) K2[Zn(OH)4]t∘→K2ZnO2+2H2O
3) K2ZnO2+4HCl=ZnCl2+2KCl+2H2O
4) ZnCl2+(NH4)2)S=ZnS↓+2H4Cl
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
бромэтан NaOH,H2O→X1→CH3COOHNaOH→X2NaOH,t∘→→X31500∘C→X4
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ включает в себя 5 уравнений реакций, соответствующих схеме превращений:
1) CH3−CH2−Br+NaOH→CH3−CH2−OH+NaBr
2) 5CH3CH2OH+4KMnO4+6H2SO4t∘→ →5CH3COOH+4MnSO4+2K2SO4+11H2O
3) CH3COOH+NaOH→CH3COONa+H2O
4) CH3COONa+NaOHt∘→CH4+Na2CO3
5) 2CH4t∘→CH≡CH+3H2 (возможно образование С и H2)
При сливании 160 г 10%-ного раствора нитрата бария и 50 г 11%-ного раствора хромата калия выпал осадок. Рассчитайте массовую долю нитрата бария в образовавшемся растворе.
Элементы ответа:
1) Записано уравнение реакции:
Ba(NO3)2 + K2CrO4 = BaCrO4↓ + 2KNO3
2) Рассчитаны количество вещества реагентов, и определено вещество, взятое в избытке:
n(Ba(NO3)2) = 160 x 0,1 / 261 = 0,061 моль
n(K2CrO4) = 50 x 0,11 / 194 = 0,028 моль
Ba(NO3)2 - в избытке
3) Рассчитаны масса выпавшего осадка и масса образовавшегося при этом раствора:
n(BaCrO4) = n(K2CrO4) = 0,028 моль
m(BaCrO4) = 0,028 моль х 253 г/моль = 7,08 г
m(раствора) = 160 + 50 - 7,08 = 202,92 г
4) Рассчитаны масса нитрата бария и его массовая доля в растворе:
n(Ba(NO3)2)изб = 0,061 - 0,028 = 0,033 моль
m(Ba(NO3)2) = 0,033 x 261 = 8,61 г
w(Ba(NO3)2) = m(Ba(NO3)2) / m(p-pa) = 8,61 / 202,92 = 0,042 или 4,2%
Смесь железа и железной окалины массой 214,4 г полностью растворили в 1 кг концентрированной серной кислоты, взятой в избытке. Известно, что при этом атомы железа в железной окалине отдали в общей сложности в 3 раза больше электронов, чем атомы металлического железа. Определите массовую долю соли в полученном растворе. (Образованием кислых солей пренебречь).
Элементы ответа:
1. Записаны уравнения реакций:
(1) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
(2) 2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O
2. Вычислено количество исходных веществ
Fe0 − 3ē = Fe+3 в реакции [1]
Fe+2 − 1ē = Fe+3 в реакции [2]
n[1]ē : n[2]ē = 1 : 3, значит n(Fe) : n(Fe3O4) = 1 : 9
Пусть n(Fe) = x моль, тогда n(Fe3O4) = 9x моль, отсюда
56x + 232 · 9х = 214,4
х = 0,1
n(Fe) = 0,1 моль, n(Fe3O4) = 0,9 моль
3. Вычислена масса сульфата железа (III) в растворе
n1(Fe2(SO4)3) = n(Fe) : 2 = 0,1 : 2 = 0,05 моль
n2(Fe2(SO4)3) = 3 · n(Fe3O4) : 2 = 3 · 0,9 : 2 = 1,35 моль
mобщ.(Fe2(SO4)3) = M · n = 400 · (0,05 + 1,35) = 560 г
4. Вычислена массовая доля сульфата железа (III)
n1(SO2) = 3 · n(Fe) : 2 = 3 · 0,1 : 2 = 0,15 моль
n2(SO2) = n(Fe3O4) : 2 = 0,9 : 2 = 0,45 моль
m(общ)(SO2) = n(общ) · M = (0,15 + 0,45) · 64 = 38,4 г
m(конеч. р-ра) = m(р-ра)(H2SO4) + m(Fe) + m(Fe3O4) − m(общ)(SO2)
m(конеч. р-ра) = 1000 + 214,4 − 38,4 = 1176 г
ω(Fe(NO3)3) = 560 : 1176 · 100 % = 47,62 %
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||